Si hay un colectivo de personas para quienes el poder acceder a nuevos tratamientos para sus heridas, es sin lugar a dudas, el de los pacientes que sufren la Piel de Mariposa, y retrasar su acceso a los mismos es una manera muy cruel de afectar a su salud y a su calidad de vida, ante un problema sin (hasta ahora) otras opciones terapéuticas.
Con motivo del Día Internacional de las Enfermedades Raras, os reproducimos, y compartimos plenamente, información facilitada por DEBRA España para denunciar que la burocracia sanitaria “está abriendo heridas” en pacientes con Piel de Mariposa, una enfermedad incurable que se caracteriza por la extrema fragilidad de la piel, y que afecta a más de 500 personas en España. 
La ONG DEBRA Piel de Mariposa reclama que “se cumplan los plazos establecidos por la ley” para incluir en el Sistema Nacional de Salud (SNS) un medicamento que agiliza la cicatrización de las heridas.
- Las familias con Piel de Mariposa tendrán que esperar aproximadamente 3 años más hasta que puedan acceder al tratamiento a través del SNS, cuando la legislación marca un plazo máximo de 6 meses.
- España es uno de los países de la Unión Europea que más tarda en incluir los medicamentos indicados para enfermedades raras dentro de la cartera de salud.
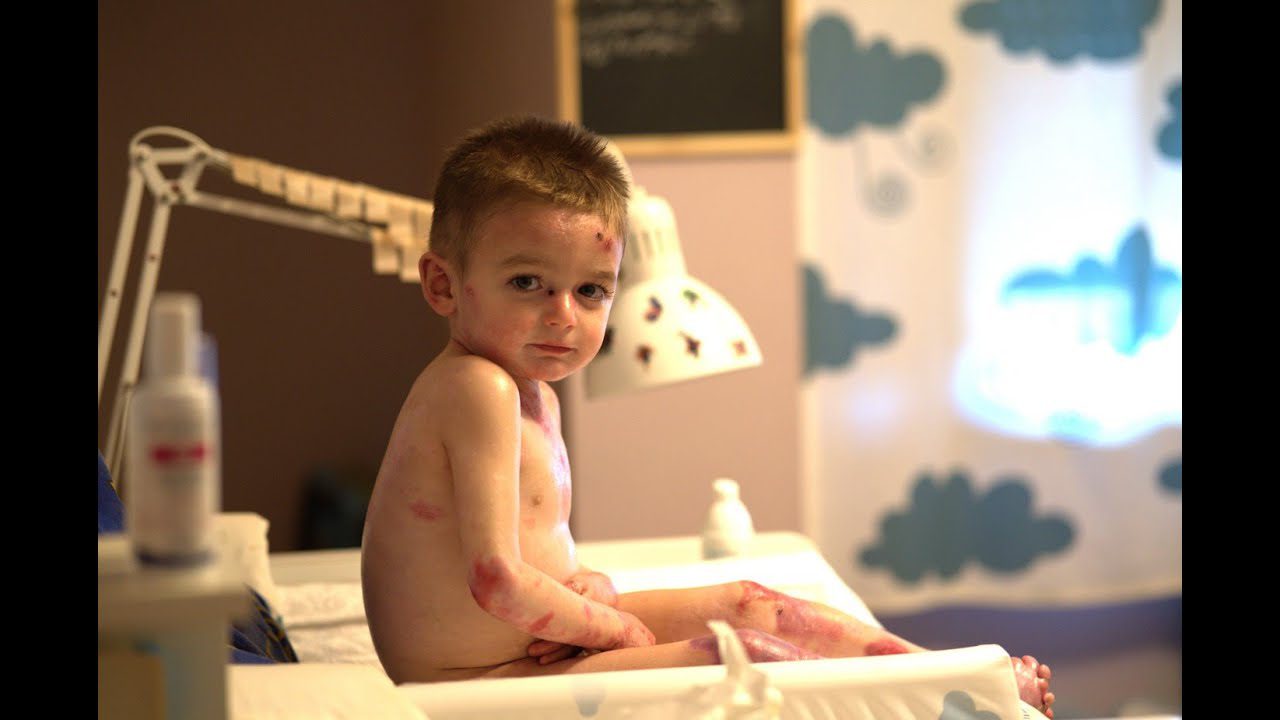
- La Piel de Mariposa es una enfermedad rara, degenerativa e incurable que provoca heridas hasta en el 90% del cuerpo.
- DEBRA Piel de Mariposa es la única organización que trata de mejorar la calidad de vida de las familias afectadas.
- Esta es una situación muy triste e injusta, por ello, reclamamos que se cumplan los plazos establecidos por la ley para incluir en el Sistema Nacional de Salud un medicamento que agiliza la cicatrización de las heridas en pacientes con Piel de Mariposa.
La dura e injusta realidad es que las familias con Piel de Mariposa tendrán que esperar aproximadamente 3 años más hasta que puedan acceder al tratamiento a través del SNS, cuando la legislación marca un plazo máximo de 6 meses.
El Dr. Raúl de Lucas describe esta situación muy claramente en este video y aquí podéis encontrar más información al respecto desde DEBRA España.
APOYAR CON VUESTRA FIRMA EL MANIFIESTO DE DEBRA ESPAÑA
Y si queréis saber un poco más:
CRONOLOGIA
Lunes 26 de febrero de 2024. “Cuando el FILSUVEZ, medicamento desarrollado por la farmacéutica Amryt Pharma (ahora Chiesi), fue aprobado por la Agencia Europea del Medicamento (EMA) en junio de 2022, las familias con Epidermólisis bullosa (EB) o Piel de Mariposa, vieron por fin un halo de esperanza. Ante una enfermedad que supone tener de forma continua heridas abiertas hasta en el 90% del cuerpo, y que aún no tiene cura, el acceso de este primer tratamiento indicado para la EB distrófica y juntural de aplicación tópica, es clave para mejorar su calidad de vida, ya que deben someterse diariamente a dolorosas curas diarias de hasta cinco horas”, afirma Evanina Morcillo Makow, directora de la ONG DEBRA Piel de Mariposa.
Sin embargo, la burocracia sanitaria está atrasando la aprobación en España de este medicamento a base de corteza de abedul, que agiliza la cicatrización de las heridas.
Por eso, desde la organización, piden “que se cumplan los plazos establecidos y que se acelere al máximo el proceso para que las personas afectadas puedan acceder lo antes posible al tratamiento. De este modo, se evitaría un sufrimiento innecesario de unas familias que ya llevan esperando dos años, y que tendrán que esperar otros tres más hasta que se incluya en el Sistema Nacional de Salud. “Un tiempo en el que las heridas siguen abriéndose, y en el que se desarrollan complicaciones más severas, tales como carcinomas e infecciones generalizadas”.
“Un hecho desesperante”, según la Asociación ya que no se podrían superar los 6 meses, según marca el ‘Artículo 3.4 del Real Decreto sobre la reorganización de la intervención de precios de las especialidades farmacéuticas de uso humano’, y según confirma el derecho comunitario (Directiva 89/105/CEE del Consejo de 21 de diciembre de 1988).
Plazos para la aprobación de un medicamento huérfano
Desde que un tratamiento recibe la designación de medicamento huérfano (tal y como se conocen los tratamientos prescritos para las enfermedades raras), se deben pasar por diversas fases:
- Tras la revisión de la Agencia Europea del Medicamento (EMA), y una vez que la Comisión Europea lo autoriza, la Asociación Española de Medicamentos y Productos Sanitarios (AEMPS) publica el Informe de Posicionamiento Terapéutico (IPT). Un paso que, por cierto, no existe en otros países de la Unión Europea, como Alemania.
- Seguidamente, se asigna un Código Nacional. Un proceso que, junto con el IPT, suele conllevar una espera de un año y medio. Una vez que se negocia el precio de reembolso con el Ministerio de Sanidad (entre 2 y 3 años), se incluye definitivamente en el Sistema Nacional de Salud. La ley, sin embargo, establece un plazo máximo de 6 meses y no de 3 años en este último tramo.
Es decir, que desde que el tratamiento ha pasado todas las pruebas y ensayos clínicos sobre su eficacia y seguridad, los pacientes deben esperar aproximadamente 5 años para poder beneficiarse de su efecto.
Farmaindustria indica a este respecto, que “la Administración Pública debería establecer criterios claros, con plazos determinados, que permitan a las compañías farmacéuticas conocer cómo tienen que realizar sus propuestas para que los medicamentos huérfanos entren en la financiación de forma más rápida y eficaz”.
Solicitud como medicamento extranjero
El medicamento Filsuvez ya está incluido en el sistema nacional de salud de países como Alemania, por lo que algunas familias han podido solicitarlo a través de su hospital como “medicamento en situaciones especiales” (medicamento extranjero).
El problema, según indican desde la ONG, es que, “de nuevo, se encuentran con más trabas burocráticas y un proceso tedioso que, en muchas ocasiones, se salda con una negativa por parte del hospital, generando así una gran inequidad entre las familias”. Esto sucede, como afirma Núria Tarrats, responsable de investigación de DEBRA, por varios motivos:
“Esta desigualdad viene dada porque en España tenemos 17 sistemas sanitarios distintos. Dependiendo de la comunidad en la que vivan las familias, van a tener más o menos facilidades de obtener este medicamento, tanto por el funcionamiento del propio hospital y de cada Consejería de Sanidad, como por el conocimiento del que disponga el equipo sanitario sobre la enfermedad y sobre los nuevos tratamientos.” Por otro lado, se suma la falta de personal sanitario que, en muchas ocasiones, no puede asumir la carga de trabajo a mayores que supone la puesta en marcha de estos trámites”, sentencia. 
Las enfermedades raras, una asignatura pendiente
Cabe destacar que España tiene una asignatura pendiente en cuanto a enfermedades raras se refiere, ya que es uno de los países de la Unión Europea con menos tratamientos aprobados y financiados por el Sistema Nacional de Salud (solo 78 frente a los 147 de Europa) y es, además, uno de los que más tarda en incluirlos. El informe del último estudio W.A.I.T. Indicator, promovido por la EFPIA (Federación Europea de Industrias Farmacéuticas), realizado sobre medicamentos huérfanos autorizados entre 2017 y 2021, mostró que en España están disponibles solo el 51% de los medicamentos huérfanos que podrían ayudar a las familias afectadas, mientras que en Italia están disponibles alrededor del 80% y, en Alemania, el 90%.
Además, en la actualidad, hay 45 medicamentos huérfanos sin financiar en España. Casi la mitad (49%) lleva más de 3 años esperando su incorporación al SNS. Según el informe aeLmhu de 2023 (Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos), la principal razón por la falta de financiación a nivel estatal es “la racionalización del gasto público y el valor terapéutico y social del nuevo tratamiento”. Es decir, que al tratarse de un medicamento destinado a una enfermedad rara, está indicado a un porcentaje muy reducido de población, por lo que no se considera prioritario, a pesar de la gravedad.
Otros medicamentos esperanzadores para la Piel de Mariposa
VYJUVEK, un medicamento impulsado por Krystal Biotech, y desarrollado por la Universidad de Standford, es uno de los medicamentos más esperanzadores hasta la fecha, indicado para el tratamiento de la Epidermólisis bullosa distrófica. Se trata de una terapia génica de aplicación tópica, que da la información necesaria a las células para que puedan producir, durante meses, el Colágeno 7 (proteína responsable de unir la dermis y la epidermis, y de hacerla resistente a golpes y roces).Por el momento, está aprobada por la FDA (Agencia del Medicamento de EE.UU.) y actualmente está en revisión por la EMA. Se espera que en octubre de 2024 haya una aprobación por parte de la Comisión Europea.
Sobre la Piel de Mariposa
Denominada científicamente Epidermólisis bullosa (EB), la Piel de Mariposa es una enfermedad rara, genética e incurable, que afecta a más de 500 personas en España, y que provoca una extrema fragilidad de la piel.
Para quienes la sufren, el más mínimo roce puede provocarles heridas, llegando a cubrir hasta el 90% de su cuerpo, ya que carecen de distintas proteínas que hacen que la piel se pegue correctamente al cuerpo. Por ello, deben someterse diariamente a dolorosas curas de hasta 5 horas. Los apósitos y vendajes son su segunda piel. Como consecuencia de ello, acciones de la vida cotidiana como vestirse, comer o caminar, pueden resultar extremadamente dolorosas.
Sobre DEBRA Piel de Mariposa
DEBRA Piel de Mariposa es una entidad sin ánimo de lucro fundada en 1993 por los padres de un niño con Epidermólisis bullosa (EB) o Piel de Mariposa, que tiene por objetivo mejorar la calidad de vida de las familias con esta enfermedad a nivel nacional. El equipo de enfermeras, psicólogas y trabajadoras sociales que conforma la organización, se encarga de informar, asesorar, guiar y acompañar tanto a las familias con Epidermólisis bullosa como a los profesionales, a lo largo de todas las etapas de su vida.
En el caso de los nuevos nacimientos, por ejemplo, el equipo de DEBRA Piel de Mariposa se desplaza en un plazo máximo de 48 horas a los hospitales de cualquier punto de la geografía española, para acompañarlas en esos momentos en los que el miedo y la desolación se apoderan de la situación.
Asimismo, DEBRA impulsa la financiación de proyectos de investigación en EB, y promueve campañas de sensibilización para visibilizar y concienciar sobre las dificultades y barreras que tienen que vencer a diario las personas con Piel de Mariposa.
¡¡Muchas gracias amig@s de DEBRA España¡¡
(Imágenes del fotógrafo Martín Corradini cedidas por DEBRA España)